При изучении механизма химической реакции. катализируемой ферментами. исследователя постоянно интересует не только определение промежуточных и конечных продуктов и выяснение отдельных стадий реакции. но и природа тех функциональных групп в молекуле фермента. каковые снабжают специфичность действия фермента на этот субстрат (субстраты ) и высокую каталитическую активность. Речь заходит, следовательно, о правильном знании третичной структуры и геометрии фермента. и химической природы того участка (участков) молекулы фермента. что снабжает высокую скорость каталитической реакции.
Участвующие в ферментативных реакциях молекулы субстратов довольно часто имеют маленькие размеры если сравнивать с молекулами ферментов. исходя из этого было высказано предположение, что при образовании фермент-субстратных комплексов в яркий контакт с молекулой субстрата. разумеется, вступает ограниченная часть аминокислот пептидной цепи. Из этого появилось представление об активном центре фермента.
Под активным центром подразумевают неповторимую комбинацию аминокислотных остатков в молекуле фермента. снабжающую яркое связывание ее с молекулой субстрата и прямое участие в акте катализа (рис. 4.2). Установлено, что у сложных ферментов в состав активного центра входят кроме этого просте-тические группы.
В активном центре условно различают так называемый каталитический центр, конкретно вступающий в химическое сотрудничество с субстратом. и связывающий центр, либо контактную («якорную») площадку, которая снабжает своеобразное сродство к субстрату и формирование его комплекса с ферментом. Со своей стороны молекула субстрата кроме этого содержит функционально разные участки: к примеру, субстраты эстераз либо протеиназ – одну своеобразную сообщение (либо группу атомов ), подвергающуюся атаке со стороны фермента. и один либо пара участков, избирательно связываемых ферментом .
Чёрные полосы — участки полипептидной цепи фермента ; R — аминокислотные остатки и их порядковые номера (с N-финиша).
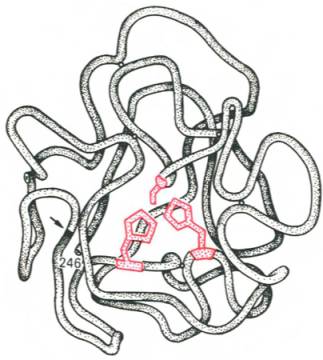
Взяты экспериментальные доказательства наличия в активном центре химотрипсина двух остатка серина и остатков гистидина. схематически представленных в трехмерной структурной модели предшественника этого фермента (рис. 4.3). Обнаружение химической вероятной топографии и природы групп активного центра – неприятность первостепенной важности. Она сводится к определению природы аминокислот. их взаиморасположения и последовательности в активном центре.
Для идентификации так называемых значительных аминокислотных остатков применяют своеобразные ингибиторы ферментов (довольно часто это субстратподобные вещества либо аналоги коферментов ), способы «мягкого» (ограниченного) гидролиза в сочетании с химической модификацией, включающей избирательное окисление. связывание, замещение остатков аминокислот и др.
Рис. 4.3. Гипотетическая модель третичной структуры молекулы предшественника химотрипсина (по Ней-рату).
Цветом выделены остатки серина и гисти-дина; стрелкой обозначено место отщепления N-концевого участка полипептидной цепи.
При помощи способов ингибиторного анализа были предприняты попытки установить структуры и закономерности состава активных центров у ферментов. относящихся к различным группам. В частности, при применении диизопропилфторфосфата (ДФФ ), принадлежащего к так называемым нервным ядам, отмечается полное выключение активного центра холинэстеразы – фермента. катализирующего гидролиз ацетилхолина на уксусную кислоту и холин.
Оказалось, что данный ингибитор имеет близкое структурное сходство с ацетилхолином и подобно ему взаимодействует с ОН-группой остатка серина в активном центре. Приводя к фосфорилированию серина в активном центре последовательности вторых ферментов. ДФФ кроме этого инактивирует их воздействие:
Продемонстрировано, что ДФФ избирательно фосфорилирует в каждом чувствительном к нему ферменте лишь один остаток серина. наделенный функциональной активностью. Учитывая данный механизм действия ДФФ. сделаны попытки определения природы аминокислот в окружении «каталитического» остатка
серина у последовательности ферментов (табл. 4.2).
Из данных табл. 4.2 видно, что ферменты. сходные по типу действия, не смотря на то, что и различаются специфичностью. смогут иметь практически однообразную последовательность аминокислотных остатков в тех участках, каковые примыкают к остатку серина. несущему функционально активную гидро-ксильную группу. Значительное значение ОН-группы серина для акта катализа было доказано, помимо этого, химическим ее блокированием либо удалением, в то время, когда эстеразы всецело лишались ферментативной активности .
Предполагают, что формирование активного центра фермента начинается уже на ранних этапах синтеза белка-фермента (см. главу 14) на рибосоме. в то время, когда линейная одномерная структура пептидной цепи преобразовывается в трехмерное тело строго определенной конфигурации. Появившийся белок получает данные совсем нового типа, в частности функциональную (в частности, каталитическую).
Каждые действия, приводящие к денатурации. т.е. нарушению третичной структуры, приводят к искажению либо разрушению структуры активного центра и соответственно утрата ферментом каталитических особенностей. В случае если при подходящих внешних условиях удается вернуть нативную трехмерную структуру белка-фермента (ренатурировать его), то восстанавливается и его каталитическая активность. Это было продемонстрировано в первый раз на примере рибо-нуклеазы поджелудочной железы (см. рис.
1.13).
Кроме активного центра. в молекуле фермента может находиться кроме этого аллостерический центр (либо центры) (от греч. allos – второй, другой и steros – пространственный, структурный), воображающий собой участок молекулы фермента. с которым связываются определенные, в большинстве случаев низкомолекулярные, вещества (эффекторы, либо модификаторы), молекулы которых отличаются по структуре от субстратов. Присоединение эффектора к аллостерическому центру изменяет третичную и довольно часто кроме этого четвертичную структуру молекулы фермента и соответственно конфигурацию активного центра. приводя к повышению либо снижению энзимати-ческой активности. Ферменты. активность каталитического центра которых подвергается трансформации под влиянием аллостерических эффекторов, связывающихся с аллостерическим центром, стали называться аллосте-рических ферментов .
Рис. 4.4. Схематическое изображение аллостерического фермента. складывающегося из двух протомеров, соединенных по типу гетерологи-ческой («голова»-«хвост») ассоциации (по Кошленду).
S – субстрат ; М1 – модификатор, связывающийся в активном центре ; М2 – модификатор, связывающийся в аллосте-рическом центре (эффектор).
Отличительной изюминкой последовательности аллостерических ферментов есть наличие в молекуле олигомерного фермента нескольких активных центров и нескольких аллостерических регуляторных центров, пространственно удаленных друг от друга. В аллостерическом ферменте любой из двух симметрично выстроенных протомеров содержит один деятельный центр. связывающий субстрат S, и один аллостерический центр, связывающий эффектор М2. т.е. 2 центра в одной молекуле фермента (рис.
4.4). Взяты доказательства, что для субстрата аллостерические ферменты. кроме активного центра. содержат и без того именуемые эффекторные центры; при связывании с эффекторным центром субстрат не подвергается каталитическому превращению, но он воздействует на каталитическую эффективность активного центра. Подобные сотрудничества между центрами, связывающими лиганды одного типа, принято именовать гомотропными сотрудничествами, а сотрудничества между центрами, связывающими лиганды различных типов, – гетеротропными сотрудничествами .
Так, приведенные сведения о химической природе активного центра и аллостерических участках говорят о том, что в энзима-тическом катализе. как и в реакции связывания субстрата. участвует не ограниченная и часть фермента. как предполагалось ранее, а намного большая часть молекулы белка-фермента. Этими событиями, наверное, возможно растолковать объёмность и большие размеры трехмерной структуры молекулы фермента ; эти же события направляться учитывать в программах создания неестественных низкомолекулярных аналогов ферментов (синзимов), владеющих особенностями на-тивных ферментов (см. ранее).
Источник: www.xumuk.ru
Ферменты – биологические катализаторы. Значение ферментов
Интересные записи
- Как оплатить телефон, алиэкспресс, киви через вебмани?
- Определение расчетного расхода холодной воды
- Что такое паспорт сделки? в каком случае оформляется паспорт сделки?
Похожие статьи, которые вам, наверника будут интересны:
-
Центр обработки данных надежная упаковка
Создание центра обработки данных есть нужным условием для динамичного развития банка. Но для реализации проекта подчас требуются миллионные инвестиции.//…
-
Отзывы: 0 Дисконт-центр Орджоникидзе 11 приглашает Вас на увлекательный шопинг. Этот дисконт-центр стал одним из первых Магазинов в Москве аналогичного…
-
Дисконт центры адидас ориджинал в москве 2010
Общеизвестно, что обувь и одежда adidas и adidas originals пользуется у нас, да и в Москве в частности громадной популярностью. Многие желают ходить в…
-
Нарастающая дестабилизация мировых денежных рынков и рост интернациональной борьбе делают все более актуальной идею создания в Российской Федерации…
-
Как включить службу центра обеспечения безопасности windows 7
Отключение уведомлений Центра Помощи Отключение показа уведомлений о проблемах безопасности, на случай неосуществимости их устранения. Центр Помощи…
-
Мария христолюбова, банк «центр-инвест»: «по нашим кредитам не было ни одной просрочки»
О преимуществах работы с дамами-предпринимателями и изюминках бизнес-кредитования в интервью Bankir.Ru поведала заместитель руководителя по работе с…